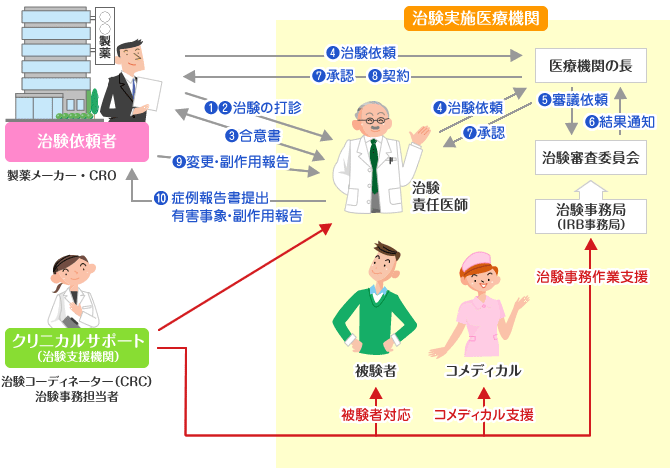
治験実施までの流れ
治験実施体制と流れ
当社はSMOとして治験実施医療機関から委託を受け、医療機関の治験業務を支援しております。
医療機関の治験実施までの流れを簡単にご紹介します。
医療機関の治験実施までの流れを簡単にご紹介します。
①
| まず最初に治験依頼者が治験実施医療機関、治験責任医師の選定をします。
|
②
| 次に治験依頼者が治験責任医師に治験の打診をします。
|
③
| 治験責任医師が治験の内諾をすると、治験依頼者と治験責任医師の間で合意書を交わします。
|
④
| 治験依頼者と治験責任医師は、病院長に治験依頼書を提出して審査の依頼をします。
|
⑤
| 病院長は治験審査委員会に審議依頼をします。
|
⑥
| 治験審査委員会の審議後、結果は病院長に通知されます。
|
⑦
| 病院長は治験依頼者、治験責任医師に結果を通知します。
|
⑧
| 審議結果が承認になりますと、治験依頼者と実施医療機関の間で契約を締結し、治験開始となります。
|
⑨
| 治験実施中、治験依頼者は治験実施計画書の変更や副作用報告などの諸情報を随時治験責任医師及び病院長に伝えます。
|
⑩
| 治験責任医師は治験依頼者に被験者のデータを記載した症例報告書を提出し、有害事象、副作用が発生した際は報告します。
|
治験の体制整備の支援
治験をしたいが医療機関内の体制が整っていない、しばらく治験をしておらず整備できているかよくわからないといった医療機関へ、治験体制整備の支援を行っております。
体制整備のスケジュール例をご覧ください。
体制整備のスケジュール例をご覧ください。
基盤整備のスケジュール例
病院長・医師
| 医局説明会への出席
| 治験実施体制の決定
| 病院長による各種、承認(決裁など)
| |
標準業務
手順書整備 | 標準手順書(案)の作成
※弊社にて説明他行います。 | 標準手順書検討
| 病院長による標準手順書の承認(決裁など)
| |
治験審査
委員会(IRB) | 審査委員(院内)選出
外部委員選出 | 審査委員決定
治験審査委員会委員長決定 | 病院長による審査委員の指名
| |
各種事務局
作業 | 治験審査委員会事務局設置
治験事務局設置 | 治験事務局長決定
審査委員指名書兼名簿作成 | 審議資料作成、送付進行表作成
審査依頼書の作成 | |
経費の細則
決定 | 研究費、間接経費等治験に関わる費用の規定(受託算定規定)の検討
| 病院長による受託算定規定の承認(決裁など)
| ||
その他
関連部署 | 医局説明会への出席
| 治験担当窓口決定
治験薬管理責任者決定 記録保存責任者決定 | ||
SMOとの
契約 | ・医局説明会等の実施
※弊社にて説明他行います。 | ・基本契約書(案)検討
※弊社にて説明他行います。 | 基本契約書締結
(SMO←→医療機関) |

